Indice Anterior Siguiente
Revista de Ciencias Médicas La Habana 2014; 20(2)
ARTÍCULO DE REVISIÓN
Norlan de la Cruz Alfonso,I Rolando Martínez López,II Anniuska Gigato DiazIII
IEspecialista de I grado en Medicina General Integral y de I grado en Gastroenterología. Máster en Enfermedades Infecciosas. Profesor Asistente. Hospital General Docente “Aleida Fernández Chardiet”, Güines, Mayabeque, Cuba. E-mail: norlan.delacruz@infomed.sld.cu
IIEspecialista I grado en Medicina General Integral y de II grado en Gastroenterología. Profesor e Investigador Auxiliar. Centro Nacional de Cirugía de Mínimo Acceso. La Habana, Cuba. E-mail: rolando@cce.sld.cu
IIEspecialista I grado en Medicina General Integral y de I grado en Gastroenterología. Profesor Auxiliar. Centro Nacional de Cirugía de Mínimo Acceso. La Habana, Cuba. E-mail: gigato@infomed.sld.cu
RESUMEN
Los tumores mucinosos del páncreas son lesiones premalignas que cursan casi siempre de forma asintomática y la mayoría de las veces se realiza su detección de forma incidental. Tanto el diagnóstico como la conducta terapéutica constituyen un reto para las diferentes especialidades involucradas en el manejo de estas lesiones, dadas las diferencias en la historia natural del espectro de las lesiones: benignas, malignas y borderline; de ahí la importancia de los esfuerzos por lograr consensuar criterios en aras de un mejor seguimiento. Interesados por estos elementos se decide realizar esta revisión bibliográfica de los tumores mucinosos del páncreas e identificar los criterios para el diagnóstico y la conducta a seguir. Para lograr este objetivo se revisó la bibliografía más actualizada consultando revistas digitales, impresas y temas obtenidos de diferentes sitios Web, incluyendo la guía del consenso internacional para el manejo de los tumores mucinosos pancreáticos.
Palabras clave: tumor mucinoso del páncreas, tumor quístico mucinoso, tumor intraductal papilar mucinoso.
ABSTRACT
Mucinous tumors of the pancreas are premalignant lesions that occur almost always asymptomatic and most of the time they are detected incidentally. Both the diagnosis and therapeutic behavior constitute a challenge for the different specialties involved in the management of these lesions, given the differences in the natural history of the spectrum of lesions: benign, malignant and borderline; hence the importance of efforts to achieve consensus criteria in order to better monitoring. The authors were interested in these items, so it was decided to conduct this bibliographic review on mucinous tumors of the pancreas and to identify the criteria for diagnosis and behavior to follow. To achieve this goal the most updated bibliography was reviewed, it was consulted digital journals, printed ones and themes obtained from different Web sites, including the international consensus guidelines for management of pancreatic mucinous tumors.
Key words: mucinous tumor of the pancreas, mucinous cystic tumor, intraductal papillary mucinous tumor.
INTRODUCCIÓN
Los tumores quísticos del páncreas son raros, representan aproximadamente el 10 % de los quistes pancreáticos y el 1 % de los tumores de páncreas. Estos fueron descritos desde el siglo XIX. Los tumores quísticos mucinosos (TQM), los cistoadenomas serosos y los tumores intraductales papilares mucinosos (TIPM) comprenden más del 90 % de las neoplasias quísticas primarias del páncreas.1
Durante los últimos años, ha sido posible el diagnóstico de una mayor cantidad de lesiones denominadas «incidentalomas», de las cuales las lesiones quísticas pancreáticas representan una importante proporción. Este fenómeno ha sido claramente descrito por el grupo del Massachussets General Hospital, quienes comunican cómo ellos han duplicado las resecciones pancreáticas efectuadas por tumores quísticos durante la última década.2
Igual tendencia se observa en el reporte efectuado por Allen, de la experiencia del Memorial Sloan Kettering Center, quienes muestran un aumento en los casos evaluados, con 5 casos en 1995 comparado con 117 en 2004.3
En 1996 la Organización Mundial de la Salud (OMS), clasificó las neoplasias quísticas del páncreas productoras de mucina en dos entidades distintas: el TIPM y el TQM.4
Las lesiones quísticas pancreáticas apenas cursan con sintomatología, casi siempre asintomáticas y los síntomas cuando se presentan son debidos al efecto masa; en un gran número de pacientes el diagnóstico se realiza de forma incidental al realizar los estudios imagenológicos de abdomen.
Para realizar el diagnóstico las pruebas imagenológicas son esenciales, estas facilitan las características de las lesiones y permiten junto a los datos clínicos realizar el diagnóstico diferencial. Las más importantes son la colangiopancreatografía retrógrada endoscópica (CPRE), la colangiorresonancia magnética, la TAC, y la ecoendoscopia, ésta última, permite la toma de muestra para citología y realizar determinaciones de amilasa y antígeno carcinoembrionario.
El manejo de las lesiones quísticas del páncreas interesa tanto al cirujano general y pancreático como a los especialistas en otras disciplinas: gastroenterología, medicina interna, endoscopia, radiología, anatomía patológica, etc.
El diagnóstico preoperatorio es crucial, dadas las diferencias en la historia natural del espectro de las lesiones: benignas, malignas y borderline. El cistadenoma seroso es una lesión benigna que no precisa resección quirúrgica, salvo cuando es sintomática.
Las neoplasias mucinosas son lesiones premalignas que requieren mayoritariamente resección pancreática. A pesar de los avances en las técnicas de imagen, el diagnóstico definitivo se establece únicamente tras el estudio histológico de la pieza de resección. El riesgo que comporta la cirugía pancreática es un problema asociado al manejo apropiado de estos pacientes.1
Aunque de forma general se plantea que todos los tumores mucinosos deben tener resección, existe consenso internacional sobre la conducta a seguir ante dichas lesiones. El tratamiento de los tumores mucinosos depende de si se trata de un TIPM o TQM, en el caso del primero la conducta es diferente si la lesión es de rama secundaria o es del conducto principal, además de otras características no menos importantes como son el tamaño y la presencia o no de nódulos intramurales, esto condicionaría la forma del seguimiento de los pacientes.5
En el caso de los TQM, donde la posibilidad de evolución al cáncer es más frecuente la conducta es la resección, muchas veces orientada por predictores de malignidad como el tamaño, nódulos murales y la presencia de calcificaciones.6
Sin lugar a dudas, tanto el diagnóstico como la conducta terapéutica constituyen un reto para las diferentes especialidades involucradas en el manejo de estas lesiones, de ahí la importancia de los esfuerzos por lograr consensuar criterios en aras de un mejor seguimiento.
Interesados por estos elementos teóricos se decide realizar esta revisión de los tumores mucinosos del páncreas e identificar los criterios para el diagnóstico y la conducta a seguir en cada caso.
DESARROLLO
Tumor intraductal papilar mucinoso
Los TIPM fueron descritos por primera vez en el año 1982, por Ohashi y colaboradores,7 al relacionar la salida de material mucinoso a través de la ampolla de Vater en un caso de tumor de páncreas. También se le ha denominado adenoma velloso, neoplasia papilar, carcinoma papilar, ectasia ductal mucinosa o tumor productor de mucina del páncreas.8
La OMS definió a los TIPM del páncreas como un tumor caracterizado por la dilatación del conducto pancreático principal o de sus ramas secundarias, que se encuentra revestido por epitelio cilíndrico, con o sin formación de proyecciones papilares, que se asocia a la producción de mucina y que carece de estroma de tipo ovárico, lo que lo diferencia de la neoplasia mucinosa quística del páncreas.9-10
Epidemiología
Afecta con mayor frecuencia a varones entre 60 y 70 años, (relación H: M/3:2) con síntomas de pancreatitis crónica o pancreatitis aguda recidivante, sin factores predisponentes (alcohol, colelitiasis, hiperlipidemia, etc.) ni etiología filiada. Estos síntomas, atribuibles a la obstrucción del conducto pancreático por moco, están ausentes en un 10-20 % de los casos incidentales.
Múltiples alteraciones genéticas y epigenéticas se asocian a los TIPM11. Como en el adenocarcinoma ductal de páncreas, se han detectado mutaciones en el oncogén K-ras en un 80 % de los casos. También se han descrito asociaciones de los TIPM con algunos síndromes hereditarios y familiares como el Peutz-Jeghers y la poliposis familiar adenomatosa,12 así como otras neoplasias malignas extrapancreáticas como el carcinoma colorrectal o gástrico.13-14
Anatomía patológica
Los TIPM son tumores productores de mucina que se localizan en el conducto pancreático principal o en sus ramas y se caracteriza por la proliferación intraductal de células mucinosas neoplásicas, las que frecuentemente forman papilas y llevan a la dilatación quística del conducto afectado.
La apariencia macroscópica dependerá del conducto pancreático afectado (principal o secundario), el tamaño y la cantidad de mucina producida. Estos tumores se pueden localizar en cualquier parte del páncreas, pero son más frecuentes en la cabeza (70 %). En 20 % de los enfermos el compromiso es únicamente de la cola y en 10 % es difuso.15
En el estudio microscópico se puede observar que la proliferación intraductal puede variar desde un epitelio mucinoso plano que tapiza un conducto dilatado, hasta una compleja formación de papilas.
Morfológicamente se distinguen cuatro variantes: ectasia difusa del ducto principal, ectasia segmentaria del ducto principal, ectasia ductal de ramas secundarias localizada predominantemente en cabeza de páncreas o uncinado y quistes comunicados con el ducto pancreático de forma unifocal o multifocal.16
Con base en los estudios de imagen y la histología, se pueden clasificar en tres subtipos según la afección sea: a) del ducto principal, difusa o segmentaria (main duct-type); b) de ramas secundarias, macroquística o microquística (branch duct-type), y c) de tipo mixto, tanto de ducto principal como de ramas secundarias. La diferenciación entre los tres tipos de afección es crucial en cuanto al pronóstico.
Dependiendo de las características de las células que revisten los conductos, los TIPM se pueden dividir en: TIPM de tipo gástrico: Las células que revisten las papilas o la dilatación quística son cilíndricas altas, con abundante mucina apical, semejante a las células foveolares gástricas. TIPM de tipo intestinal: Posee papilas largas, villiformes, paralelas, con células que contienen menor cantidad de mucina, pseudoestratificadas y de núcleos alargados, a veces con células caliciformes. TIPM de tipo pancreatobiliar: Con papilas complejas revestidas por células cuboideas, de núcleos redondos, que recuerdan las neoplasias papilares de los conductos biliares.17
Es importante destacar que en un TIPM puede haber una mezcla de estos tres tipos. Existen además otros dos tipos de neoplasia intraductal pancreática que representan variantes de los TIPM: la neoplasia papilar intraductal oncocítica (NPIO) y la neoplasia intraductal tubular (NIT).
Otra clasificación de los TIPM es la elaborada por la OMS en el año 2000, basada en la atipia epitelial: Benignas (adenoma mucinoso papilar intraductal) donde no hay atipia o ésta es leve; tumor intraductal papilar mucinoso borderline, donde la atipia es moderada y los malignos (carcinoma mucinoso intraductal papilar invasivo o no) con acentuada atipia.
Cuadro clínico
Los TIPM no tienen una presentación clínica específica,18 en un gran número de pacientes el diagnóstico se realiza de forma incidental al realizar los estudios imagenológicos de abdomen. En ocasiones el dolor es el síntoma por el que acude el paciente a la consulta, a veces existe íctero, esteatorrea, pérdida de peso o cuadro similar al de pancreatitis recurrente traducción de la obstrucción de la vía biliar. Se ha observado que los enfermos con un TIPM son de mayor edad que los que presentan una pancreatitis crónica.19
Hay que hacer la diferenciación diagnóstica con el pseudoquiste pancreático en aquellos casos en que haya historia de pancreatitis aguda. Hay casos que se presentan con un debut de diabetes o una mala respuesta al tratamiento de una diabetes conocida.20
En el estudio realizado por D’Angelica y colaboradores18 a 63 pacientes observó que el 81 % presentaron síntomas y los más frecuentes fueron el dolor abdominal (50 %), la pérdida de peso (43 %) y la diarrea o esteatorrea (22 %).
Algunos autores plantean que tanto la pérdida de peso como la esteatorrea serían dependientes a la insuficiencia pancreática, secundarias al aumento de la producción de mucina y la posterior obstrucción del conducto pancreático. En las lesiones benignas, la ictericia es infrecuente y se debe sospechar el carácter maligno del tumor en aquellos que la presenten.
Así mismo, existen otras características que sugieren un cáncer asociado a un TIPM como son: la edad mayor y el diagnóstico tardío o la descompensación reiterada de la diabetes mellitus. También se enfatiza en que la ausencia de síntomas no es sinónimo de benignidad de la lesión y se ha observado en hasta el 30 % de los pacientes asintomáticos la presencia de cáncer in situ o invasor.15,21
Diagnóstico
Estudio por imágenes: éstas son muy importantes para identificar la lesión, clasificarla y permitir la resección.
La colangiopancreatografía retrógrada endoscópica (CPRE) es la prueba de elección,22 pues por medio de ella se logra visualizar las características de la papila de Vater, si está aumentada, protruida, si hay salida de mucina a través de la misma; además de poder observar el conducto pancreático, si tiene dilatación a este nivel o existe en los conductos segmentarios, por otra parte se valora si hay alteraciones en la pared del conducto como crecimiento de papilomas o lesión maligna sobreañadida.
Otros estudios imagenológicos de importancia son el ultrasonido, la tomografía computarizada (TAC) y la colangiorresonancia magnética (CPRM. Estos estudios permiten identificar las dos variedades de TIPM: la del conducto principal y la de los conductos secundarios.
En el caso de la variedad del conducto principal se observa dilatación más o menos acentuada de forma difusa o segmentaria y la papila protruida hacia la luz duodenal, pudiendo observar en ocasiones una imagen densa por la presencia de tumor o mucina en dicha luz.15
La variedad de conductos secundarios compromete más frecuentemente el proceso uncinado y con menos frecuencia el cuerpo y la cola. Se caracteriza por la presencia de múltiples quistes de 1 a 2 cm de diámetro, interconectados y que contienen mucina o nódulos murales. En el estudio de imagen se observa dilatación quística de ramas ductales, de contornos lobulados, con múltiples septos y que es hipo o anecogénica al US, hipodensa a la TAC e hiperintensa en secuencias ponderadas en T2 a la RM.22
La ecoendoscopia permite obtener imágenes de la pared y la lesión interna, dicho proceder permite asociar la aspiración por aguja fina y realizar el estudio citopatológico, determinaciones bioquímicas (amilasas) y de marcadores tumorales (CEA, CA19-9), así como el análisis del ADN, que pueden ayudar en el diagnóstico de las lesiones dudosas tras las otras exploraciones, lo que elevada la sensibilidad de la ecoendoscopia.23
Más recientemente se han introducido pruebas como la pancreatoscopia y ecoendoscopia intraductal que facilitan el diagnóstico de tumores pequeños e in situ, aumentando la sensibilidad diagnóstica.20
Diagnóstico diferencial
El diagnóstico diferencial de los TIPM es principalmente con pseudoquistes pancreáticos, los cistoadenomas serosos y mucinosos, así como con los cistoadenocarcinomas mucinosos. Los cistoadenomas mucinosos son más frecuentes en la mujer de edad media, y no tiene comunicación con el conducto pancreático principal y se localizan fundamentalmente en la cola del páncreas en forma de quistes mayores de 2 cm.
Los cistoadenomas serosos por su parte, son quistes menores de 2 cm que se sitúan más en la cabeza y el cuerpo, están presentes en mujeres de mayor edad y al igual que los anteriores no se comunican con el conducto pancreático principal. Los pseudoquistes pancreáticos están asociados a cuadros de pancreatitis crónica con dilatación del conducto principal y calcificaciones, se comunican con dicho conducto y carecen de producción de mucina, no hay protrusión de la papila y tampoco hay formación de nódulos murales. El otro diagnóstico diferencial de los TIPM es con la NQM, que representa una lesión macroquística, formada por quistes > 2 cm rellenos de mucina, con septos en su interior y no comunica con el interior del conducto pancreático.24
Recientemente se ha visto que los TIPM se asocian a otras neoplasias extrapancreáticas. En su estudio, Choi y colaboradores13 observaron que el 39 % de los pacientes con TIPM presentaron al menos un tumor extrapancreático, en su mayoría malignos y de localización en estómago y colon.
La carcinogénesis de los TIPM y del cáncer colorrectal es similar, desde la presencia de un adenoma hasta el desarrollo de un cáncer invasor y ambas tienen alteraciones comunes como mutaciones en el oncogen k-ras.25 Por lo anterior, todos los enfermos con una TIPM deberían ser estudiados con una endoscopia digestiva alta y una colonoscopia, con el fin de detectar en forma precoz un tumor gástrico o colónico asociado.21
Pronóstico
El pronóstico de los enfermos está dado por la resección quirúrgica completa y por la ausencia de un carcinoma invasor.15,20
Existen factores que se relacionan con el pronóstico tales como:211
Tratamiento
En casos seleccionados, en los que el tumor mide menos de 30 mm, no hay invasión mural y sólo afecta las ramas secundarias del páncreas, y sin cambios en el seguimiento, puede realizarse un manejo no quirúrgico, de observación radiológica, con marcadores tumorales y mediciones de glucemia, ya que el potencial de malignizarse o de crecer es de 11 %, a diferencia de los carcinomas que afectan las ramas principales, cuyo potencial maligno es alto (60 %) y que requieren manejo quirúrgico.
El principal objetivo de la cirugía es realizar una completa resección de la enfermedad, con márgenes negativos, con el fin de disminuir la posibilidad de recurrencia en el páncreas remanente. El tratamiento quirúrgico depende fundamentalmente del estado clínico del enfermo al momento de la cirugía y de las características de la lesión en el estudio de imágenes.
– Tumores del conducto principal: La frecuencia de malignidad (cáncer in situ o invasor) es de 60 % a 92 % y aproximadamente dos tercios de estas neoplasias son invasoras al momento del diagnóstico.15 Se ha observado que los enfermos sintomáticos, que presentan un conducto mayor de 15 mm o tienen nódulos parietales tienen una mayor probabilidad de presentar un tumor invasor.
En un estudio de Salvia y cols27 se observó que las neoplasias malignas las presentaban los pacientes de mayor edad, con ictericia y con descompensación de la diabetes. Sin embargo, también se observó que 29 % de los enfermos con cáncer fueron asintomáticos y por lo tanto, el análisis clínico y radiológico no permitió determinar con exactitud el carácter de la lesión.
La sobrevida a 5 años de los enfermos con lesiones benignas o no invasivas es cercana a 100 %, mientras que en los enfermos con lesiones malignas es de 36 %-60 %,15 por lo que se sugiere que la resección al momento del diagnóstico debe ser el tratamiento de elección de los enfermos con un TIPM que comprometa el conducto principal.
– Tumores de conductos secundarios: La posibilidad de malignidad es de 6 % a 46 % y de cáncer invasor de 0 % a 31 %.15 Esto se asocia fundamentalmente con el tamaño del conducto (> 30 mm) y con la presencia de nódulos parietales. De esta forma, aquellos enfermos asintomáticos, con dilatación del conducto periférico hasta 30 mm y sin nódulos parietales podrían ser observados y sometidos a seguimiento estricto con imágenes. Es importante considerar que esta conducta debe ser evaluada para cada caso en particular. En los enfermos sintomáticos, que requieran un seguimiento prolongado o que exista duda diagnóstica, la cirugía será el tratamiento de elección.
El tratamiento quirúrgico de elección en los enfermos con sospecha de malignidad es la pancreatectomía (pancreatoduodenectomía, pancreatectomía corporocaudal o pancreatectomía total) con disección linfática.15 En los pacientes que no presentan criterios de malignidad (clínicos, de laboratorio o imagenológicos), se puede plantear una resección segmentaria, pero teniendo en cuenta la morbilidad asociada a esta intervención y la posibilidad de una futura resección radical.
Seguimiento
Basado en estudios, las lesiones quísticas asintomáticas, sin dilatación del conducto principal (> 6 mm), aquellos sin nódulos murales y aquellos con una talla < 30 mm tienen un bajo riesgo de cáncer prevalente y un bajo riesgo de progresar a cáncer invasivo en un seguimiento de corto término (12-36 meses).
Es importante que el seguimiento sea estricto a través de técnicas de imágenes no invasivas como la colangiorresonancia o tomografía computarizada, o de técnicas invasivas como la ecoendoscopia y que provean de adecuada información sobre el tamaño de la lesión, la talla del conducto pancreático principal y presencia de nódulos intramurales.
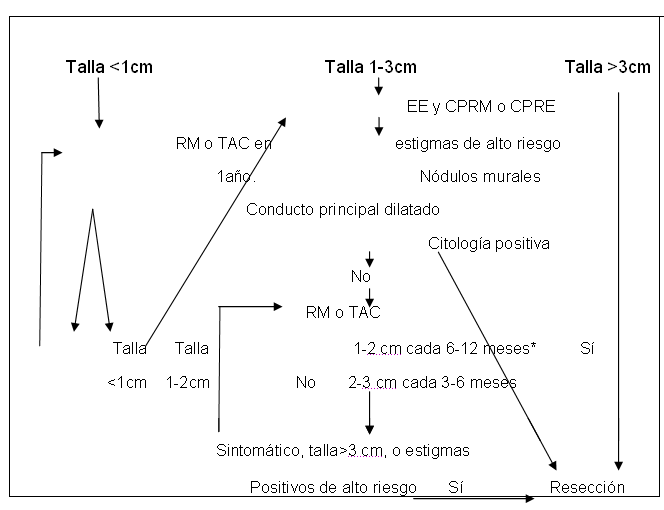
Hasta los días actuales es razonable un seguimiento anual por imagenología de la lesión con una talla < 10 mm, de 6-12 meses para lesiones entre 10 y 20 mm y de 3-6 meses para lesiones > 20 mm. En los estudios de seguimiento si apareciese síntomas como pancreatitis, presencia de nódulos intramurales, talla del quiste > 30 mm y/o dilatación del conducto pancreático principal > 6 mm, entonces estaría indicada la resección. El seguimiento puede alargarse después de 2 años sin cambios (figura).15
Fig. Algoritmo para el manejo del TIPM de ramas secundarias. *El intervalo de seguimiento puede alargarse después de 2 años sin cambios
Tumor Quístico Mucinoso
Epidemiología
Son lesiones que pueden contener epitelio benigno concomitante con tumor in situ, o incluso tumor infiltrante. Poseen frecuencias variables en las distintas series, fluctuando entre 10 % y 40 % de los tumores quísticos del páncreas. La lesión compromete predominantemente a mujeres en la quinta década e involucra de preferencia al cuerpo y la cola del páncreas.29
Anatomía patológica
Los tumores quísticos mucinosos engloban un espectro de lesiones que van desde lesiones benignas y lesiones con displasia epitelial hasta lesiones que se consideran carcinomas, sean o no infiltrativos.
Las lesiones benignas contienen un epitelio de una sola capa de células columnares productoras de mucina, la cual puede demostrarse con tinciones especiales para moco como el azul alcián o el PAS-diastasa. Las células columnares también se expresan con tinciones inmunohistoquímicas CEA y serotonina. Este epitelio suele denudarse de forma continua o discontinua, lo que puede interferir en un correcto diagnóstico de la lesión.
Es muy importante un examen histológico detallado, con inclusión completa de la lesión, para poder identificar displasia epitelial, graduarla y descartar cualquier foco invasivo que cambiaría completamente el pronóstico y el tipo de seguimiento que debe ofrecerse al paciente.
La presencia de estroma ovárica subyacente al epitelio es un requisito para el diagnóstico del TQM. Siguiendo este criterio, Goh et al,28 revisaron 344 casos de TQM con estroma ovárica y demuestran que se trata de mujeres en un 99,7 %, se localizan en cuerpo y cola en un 94,6 % de los casos y raramente comunican con el ducto pancreático (6,8 %).
Esos autores demuestran que, cuando el TQM acontece en varones y mujeres posmenopáusicas, raramente hay estroma ovárico, por lo que no puede clasificarse como TQM. En tales casos debería denominarse neoplasia quística indeterminada productora de mucina; la utilización de otros criterios puede clasificar erróneamente algunos TIPM como TQM.
Investigadores de la Clínica Mayo, propusieron una clasificación en tres subgrupos, que se considera relevante para el tratamiento y el pronóstico de estas lesiones:
Una característica de estas lesiones es la falta de comunicación con el conducto pancreático, hecho que es característico de los TIPM. Sin embargo, otros reportes describen una frecuencia de comunicación de hasta 30 %.30 Estas comunicaciones son mejor observadas mediante el empleo de resonancia nuclear magnética.
Otro hallazgo, aunque infrecuente, bastante característico de esta lesión, es la presencia de una calcificación periférica lo que le otorga el aspecto de cáscara de huevo. Este último hallazgo es muy sugerente de malignidad de la lesión. Histológicamente las cavidades están separadas por septos de tejido conjuntivo revestidas por células epiteliales de tipo columnar productoras de mucina.
La mayoría de los pacientes con TQM son asintomáticos por su localización y el diagnóstico es incidental, cuando se presentan síntomas estos son debidos al efecto masa de la lesión.
El diagnóstico diferencial se realiza con los tumores quísticos del páncreas, diferenciando en primer lugar a los TIPM, además del cistoadenoma seroso, el tumor sólido pseudopapilar y el pseudoquiste pancreático (tabla).
Tabla. Factores diferenciales de los diferentes tipos de lesiones quísticas pancreáticas
Diagnóstico por imágenes
La TAC constituye el examen que presta mayor utilidad en el estudio de estas lesiones. Estos quistes se visualizan como lesiones uniloculares o multiloculares observándose la existencia de septos y paredes. En ocasiones es también factible observar lesiones pancreáticas asociadas como son: atrofia de la glándula y dilatación del conducto pancreático.
La ecoendoscopia además de permitir visualizar bien las características de la lesión, permite la punción con aguja fina y obtener el líquido para su estudio, determinar amilasa, la histología y concentración de antígeno carcinoembrionario.
Tratamiento
A menos que haya contraindicaciones para la operación, todos los TQM deben ser resecados. Usualmente estas neoplasias se localizan en el cuerpo y la cola. Todos los TQM pueden progresar a la malignidad y la mayoría desarrollan cistoadenocarcinoma, el cual tiene un pronóstico pobre. Los predictores de malignidad son el tamaño o largo de la talla, nódulos murales y las calcificaciones.
Al tratarse frecuentemente de neoplasias no invasivas, debe intentarse una cirugía conservadora mediante resecciones económicas. Con la ecografía intraoperatoria puede determinarse la relación entre la lesión y el ducto pancreático.
En las lesiones pequeñas benignas localizadas en cabeza o proceso uncinado la técnica de elección es la enucleación. Para las lesiones localizadas en la cabeza del páncreas, de gran tamaño o en contacto con el ducto pancreático, la duodenopancreatectomía cefálica o la resección cefálica con preservación duodenal son las técnicas de elección.
En el caso de las lesiones de cuerpo o cola, las pancreatectomías corporocaudal o distal son las indicadas. En caso de lesión maligna, la resección debe ser radical con linfadenectomía asociada y, si es necesario, con resección de estructuras u órganos adyacentes (vena porta incluida) para conseguir R0. Si hay metástasis hepáticas resecables, puede plantearse su resección, aunque es discutible el beneficio a largo plazo.31
Se concluye que los tumores mucinosos del páncreas son lesiones premalignas, que cursan prácticamente asintomáticos, siendo muchas veces el diagnóstico incidental por medio de estudios imagenológicos.
Es aceptado y se sugiere que la resección al momento del diagnóstico debe ser el tratamiento de elección de los enfermos con un TIPM que comprometa el conducto principal dada la frecuencia de malignidad de esta variante, mientras que en los casos de lesión de ramas secundarias, asintomáticos, con dilatación del conducto periférico hasta 30 mm y sin nódulos parietales, podrían ser observados y sometidos a seguimiento estricto con imágenes.
A menos que haya contraindicaciones para la operación, todos los TQM deben ser resecados, la mayoría desarrollan cistoadenocarcinoma y los predictores de malignidad son el tamaño de la lesión, la presencia de nódulos murales y las calcificaciones.
REFERENCIAS BIBLIOGRÁFICAS
Recibido: 26 de diciembre de 2013.
Aprobado: 12 de febrero de 2014.
Dr. Norlan de la Cruz Alfonso.Especialista de I grado en Medicina General Integral y de I grado en Gastroenterología. Máster en Enfermedades Infecciosas. Profesor Asistente. Hospital General Docente “Aleida Fernández Chardiet”, Güines, Mayabeque, Cuba. E-mail: norlan.delacruz@infomed.sld.cu